
Escanea
en tu dispositivo móvil o revisa este artículo en:
https://doi.org/10.33996/revistavive.v7i20.313
RESUMEN
La contaminación de las áreas de preparación
al entrar en contacto con los alimentos crudos o cocinados, es por esto que una
de las principales causas de la contaminación de las superficies inertes es la inadecuada
manipulación de los alimentos a la hora de ser preparados. Con el objetivo de controlar
la aplicación de normas de higiene en las áreas de preparación y consumo de
alimentos mediante análisis microbiológicos para disminuir los riesgos de
contaminación alimentaria. Esta investigación es de carácter descriptivo, en la
cual se realizó una inspección visual del establecimiento con el propósito de
evaluar las condiciones higiénicas sanitarias, mediante la aplicación de la Guía
Técnica para el Análisis Microbiológico de Superficies en contacto con Alimentos
y Bebidas. Para el análisis microbiológico de las muestras se emplearon las
técnicas de inoculación, método de estriado, aislamiento bacteriano, tinción
diferencial y utilización de las pruebas bioquímicas como: TSI, SIM, Citrato de
Simmons, Urea, Lisina, Catalasa y Oxidasa, además de la utilización de medios
de cultivo selectivo y diferencial como agar EMB y agar MacConkey
para la identificación de bacterias entéricas como: E. coli,
Salmonella, Klebsiella pneumoniae,
Shigella, Pseudomona aeruginosa. Los resultados arrojaron que la frecuencia
bacteriana de las superficies inertes de los restaurantes en el área de
preparación de alimentos (mesón y tabla de picar) tienen presencia de bacterias:
Salmonella con mayor frecuencia; E. coli, Klebsiella pneumoniae y Pseudomonas aeruginosa de mediana
frecuencia y de baja para Shigella, y en el área de consumo
de alimentos (mesas) la bacteria de mayor frecuencia es la E. coli y Shigella, la Klebsiella pneumoniae de mediana y
Pseudomona aeruginosa se
encuentra en baja frecuencia. Se llegó a la conclusión que las superficies
inertes tanto en el área de preparación como en el área de consumo de alimentos
se encuentran contaminados por lo que hay un riesgo de infección alimentaria para
los comensales de la Universidad Técnica de Machala.
Palabras
clave: Análisis
microbiológicos; Bacterias; Contaminación alimentaria; Personal de limpieza; Superficies
inertes
ABSTRACT
Contamination of preparation areas when coming into
contact with raw or cooked
foods, which is why one
of the main causes of contamination of inert surfaces is inadequate
handling of food when it is
being prepared. With the aim
of controlling the application of hygiene standards in the areas of food preparation
and consumption through microbiological analysis to reduce the risks
of food contamination. This research is
descriptive in nature, in which a visual inspection of the establishment was carried out
with the purpose of evaluating the sanitary and hygienic conditions, through the application
of the Technical Guide for the Microbiological
Analysis of Surfaces in Contact with Food
and Beverages. For the microbiological analysis of the samples, inoculation techniques, streaking method, bacterial isolation, differential staining and use of biochemical tests such as: TSI, SIM, Simmons Citrate, Urea, Lysine, Catalase and Oxidase, in addition
to use of selective and differential culture media such
as EMB agar and MacConkey agar for
the identification of enteric bacteria such as: E. coli, Salmonella, Klebsiella pneumoniae, Shigella, Pseudomona aeruginosa. The results showed
that the bacterial frequency of the inert surfaces
of the restaurants in the food preparation area (counter and cutting board) have the presence
of bacteria: Salmonella more frequently; E. coli, Klebsiella pneumoniae and Pseudomonas aeruginosa of medium frequency and low frequency for Shigella,
and in the food consumption area (tables) the most
frequent bacteria are E. coli
and Shigella, Klebsiella pneumoniae of medium and Pseudomona aeruginosa It is at low
frequency. It was concluded that
the inert surfaces in both the preparation area and the food
consumption area are contaminated, so there is a risk of food
infection for diners at the Technical
University of Machala.
Key words: Microbiological analysis; Bacteria; Food contamination; Cleaning personnel; Inert surfaces
RESUMO
Contaminação das áreas de preparo
ao entrar em contato com alimentos crus ou cozidos,
por isso uma das principais causas de contaminação
de superfícies inertes é o manuseio
inadequado dos alimentos no momento do preparo. Com o objetivo de controlar a aplicação de padrões de higiene nas áreas de preparação e consumo
de alimentos através de análises
microbiológicas para reduzir os riscos de contaminação alimentar. Esta pesquisa é de natureza descritiva, na qual foi
realizada uma inspeção visual
do estabelecimento com a finalidade de avaliar as condições sanitárias e higiênicas, por meio da aplicação do Guia Técnico para Análise Microbiológica de Superfícies
em Contato com Alimentos e Bebidas. Para a análise microbiológica das amostras
foram utilizadas técnicas de inoculação,
método de estrias, isolamento
bacteriano, coloração diferencial e utilização de testes bioquímicos como: TSI, SIM, Citrato de
Simmons, Ureia, Lisina, Catalase
e Oxidase, além de utilização
de testes seletivos e diferenciais.
meios de cultura como ágar EMB e ágar MacConkey para identificação de bactérias entéricas como: E. coli,
Salmonella, Klebsiella pneumoniae,
Shigella, Pseudomona aeruginosa. Os resultados mostraram
que a frequência bacteriana das superfícies
inertes dos restaurantes na área de preparo de alimentos
(balcão e tábua de corte) apresentam com maior frequência a presença de bactérias: Salmonella;
E. coli, Klebsiella pneumoniae e Pseudomonas aeruginosa de média frequência e baixa frequência para Shigella, e na área de consumo alimentar (tabelas)
as bactérias mais frequentes são E. coli e Shigella, Klebsiella pneumoniae de média e Pseudomona aeruginosa Está em baixa frequência. Concluiu-se que as superfícies inertes tanto na área
de preparação como na área de
consumo de alimentos estão contaminadas, pelo que existe
risco de infecção alimentar para os comensais da Universidade Técnica
de Machala.
Palavras-chave: Análise
microbiológica; Bactérias; Contaminação
de alimentos; Pessoal de limpeza;
Superfícies inertes
INTRODUCCIÓN
En Ecuador
existe un alto índice de enfermedades transmitidas por alimentos que no han sido controladas en su totalidad, la contaminación cruzada
se da por la contaminación de las áreas de preparación al entrar en contacto con los alimentos
crudos o cocinados, es por esto que una de las principales causas de la contaminación de las superficies inertes es la inadecuada manipulación de los alimentos
a la hora de ser preparados (1). Unido a esto las malas prácticas de manipulación de los
alimentos y el desconocimiento del
concepto de contaminación cruzada por parte del personal de cocina, potencia el riesgo de contraer las
llamadas ETAS (Enfermedades
transmitidas por alimentos), con consecuencias desastrosas para la salud de la población (2).
Estas nacen de una manipulación inadecuada
de los
alimentos a la hora de ser preparados, convirtiéndose las superficies inertes en un fómite.
Actualmente es uno de los problemas más importante
de salud pública a nivel mundial tanto en
países desarrollados como en desarrollo. Los
alimentos que contienen bacterias, virus, parásitos o sustancias químicas
nocivas causan más de 200 enfermedades graves y crónicas en todo
el mundo (2). Según la OMS hace
referencia sobre la estimación de la
carga mundial de enfermedades transmitidas
por los alimentos en donde señalan que 31 agentes contaminantes biológicos que son causantes de la carga de morbilidad, que se presentan en
600 millones de casos de cada 10 habitantes,
consecuentemente la pérdida de 33 millones de años de vida ajustados en función de la discapacidad y 420.000 muertes
en todo el mundo, incluidos 125.000 niños menores
de 5 años (3).
Las
infecciones gastrointestinales son una de las
causas importantes de morbilidad, producidas
por bacterias entéricas, principalmente Escherichia coli, Klebsiella, Salmonella
y Shigella, al consumir
alimentos y agua contaminados debido a la manipulación inoportuna del
personal y de cada una de sus fases de preparación y consumo de los alimentos. Además, las infecciones agudas del tracto gastrointestinal figuran entre las enfermedades infecciosas más frecuentes.
Estos cuadros pueden presentarse en
cualquier época del año, pero el riesgo de sufrir estas enfermedades
se incrementa en la temporada de calor en la región
costa del Ecuador
(4).
El conocimiento de
la carga bacteriana presente en las fases y áreas
de preparación de alimentos en restaurantes
de la Universidad Técnica de Machala
generará información valiosa para el diseño de un programa
de limpieza y desinfección, donde los análisis
microbiológicos constituyen evidencia
para la evaluación de la higiene
(5). El objetivo de esta investigación es controlar la aplicación de normas de higiene en las áreas de preparación y consumo de alimentos
mediante análisis microbiológicos para la disminución de los riesgos
de contaminación alimentaria en restaurantes de la Universidad Técnica de Machala,
Ecuador.
MATERIALES Y MÉTODOS
El estudio
se desarrolló en la Universidad Técnica de Machala,
la cual se encuentra ubicada en la Av. Panamericana Km. 5 1/2 Vía a Pasaje, Machala, Ecuador, la cual consta
de dos patios de comida uno situado
en la Facultad de Ciencias Sociales
y en la Facultad de Ciencias Empresariales. El universo consta de once restaurantes
y 100 mesas en el área de consumo, donde cinco restaurantes y 50 mesas pertenecen a la Facultad de Ciencias Sociales,
mientras que, seis restaurantes y 50
mesas son de la Facultad de Ciencias
Empresariales, de los cuales se escogió aleatoriamente
a cuatro restaurantes de los once y 6
mesas en total,
que ha estos se les va a realizar las pruebas microbiológicas en donde se tomaron
42 muestras en total.
El trabajo
de investigación fue de diseño
no experimental, transversal y descriptivo. En inicio se realizará una inspección visual del establecimiento con el propósito de
evaluar las condiciones higiénicas sanitarias, los métodos
de higiene y saneamiento de los manipuladores y a su vez las condiciones en las que se opera diariamente. Para el muestreo se seleccionarán puntos
específicos de las áreas de preparación y consumo de alimentos de los distintos restaurantes de la Universidad Técnica de Machala. Cada restaurante cuenta con 2 tablas de picar de plástico y 1 de madera, y con
sólo 1 mesón de preparación.
Para
el trabajo se contó con información de artículos
científicos, revistas bibliográficas, sitios
web entre otros trabajos académicos.
Los
puntos de muestreo
de las diferentes áreas de preparación serán: el
mesón de preparación de alimentos, tabla de picar de cada restaurante, y en el área de consumo
de alimentos, se seleccionaron aleatoriamente tres mesas en los
restaurantes de cada facultad y fueron recolectados en 2 estaciones (mañana y tarde).
Fueron obtenidas 3 muestras de cada área del restaurante respectivamente, usando un hisopo esterilizado, humedecido con suero fisiológico. Bajo la normativa
de transporte y conservación de la muestra se colocó cada hisopo
en un tubo previamente esterilizado, tapándose con algodón,
y se colocaron en una caja cooler con hielo
para mantenerlos a una temperatura de 4°C. Para
el desarrollo de los métodos utilizados, se aplicó la Guía Técnica
para el Análisis Microbiológico de Superficies en contacto con Alimentos y Bebidas, Resolución Ministerial N°461 – MINSA (6) y Control
Microbiológico de los Alimentos: toma, envío
y preparación de Muestras para el
Análisis Microbiológico: Norma Técnica Ecuatoriana NTE INEN 1 529-2:1999 (7).
Para detección
de los microorganismos se emplearon
los siguientes métodos:
Método de estriado: Con el asa redonda
estéril se coge una fracción
de la muestra enriquecida, para
inocular en cajas Petri que contienen agar nutritivo, realizando estrías y respectivamente se procedió a incubar a 37°C, durante
48 horas.
Pasada
las 48 horas se observaron el crecimiento de las diferentes
colonias.
Método de tinción diferencial: Se procedió
a extender la muestra en un portaobjeto, se fijó la muestra con ayuda del mechero, ya una
vez fijadas las muestras se las colocó en la porta placas y procedimos a realizar la técnica
de tinción de Gram. La tinción de
Gram se la utiliza para la identificación de diferentes tipos de microorganismos según su coloración, Gram positivos (+) y
Gram negativos (-). Las bacterias teñidas
de color rosa se las identifica como gram negativas
y las de color azul como gram positivas.
Pruebas bioquímicas
Se utilizaron las pruebas de diferenciación bioquímicas para la identificación del género bacteriano de las colonias
seleccionadas.
Cada colonia
aislada fue aplicada
en tubos diferenciales: TSI (Agar triple azúcar
hierro), Sim (Agar
movilidad, indol, sulfuro de hidrogeno), Lia (Agar lisina hierro); Citrato
(Agar citrato); Urea (Agar Urea).
El procedimiento consistió en tomar una muestra
de las colonias desarrolladas en los medios de cultivos ya mencionados y se
procedió a realizar una nueva siembra, en un tubo inclinado,
con la ayuda del asa de siembra por puntura
y picadura siguiendo un eje longitudinal, en estos
medios diferenciales.
Luego
fueron incubados a 37 °C durante 24 horas, posteriormente se realizó la lectura de las
reacciones bioquímicas. Se agregaron 5 gotas del reactivo de Kovacs en los tubos con el
medio SIM, para evidenciar la presencia de indol (8).
Análisis estadísticos
Para
determinar la frecuencia bacteriana de las superficies inertes de los
restaurantes se empleó el paquete estadístico SPSS versión 21.
RESULTADOS
En Ecuador
existe un alto índice de enfermedades
transmitidas por alimentos que no han
sido controladas en su totalidad. Las malas prácticas
de manipulación de los alimentos y el desconocimiento
del concepto de contaminación cruzada por parte del personal de cocina, potencia el riesgo de contraer las
llamadas ETAS (Enfermedades transmitidas por
alimentos), con consecuencias desastrosas para la salud del consumidor.
Con el objetivo de realizar el chequeo de
esta actividad en las tres áreas de
restaurantes de la Universidad
Técnica de Machala, el monitoreo en agar
nutritivo en la Facultad de Ciencias Sociales
Tabla 1. Se observaron que en el horario de la mañana se encontraron mayor variedad color de las colonias se encontraron en el horario
de la mañana (7:30 am) con colores blancos, cremas, amerillos y verdes, con predominio de GRAM- bacilos,
estafilococos en los BAR 1 y 2 en el área de mesas,
y cremas, GRAM+ con bacilos, diplobacilos y estafilococos en el área de consumo.
Tabla 1. Monitoreo bacteriano en agar nutritivo en la Facultad
de Ciencias Sociales.
|
HORA
|
COLOR DE COLONIAS
|
BAR 1
GRAM+ GRAM-
|
BAR
GRAM+
|
2
GRAM-
|
AREA DE CONSUMO
GRAM+ GRAM-
|
|
7: 30
am
|
Blancas
|
Cocos Stafilococos
|
Bacilos
|
|
Stafilococos
|
|
|
|
|
Cremas
|
|
Stafilococos Bacilos
|
|
Stafilococos Bacilos
|
Bacilos Diplobacilos
Streptobacilos
|
Bacilos
|
|
|
Amarillas
|
|
Bacilos
|
|
|
|
Bacilos
|
|
|
Verdes
|
|
Bacilos
|
|
|
|
|
|
11: 30
am
|
Blancas
Cremas
|
Stafilococos
|
Bacilos
|
Stafilococos
Stafilococos
|
|
Cocos
|
Bacilos
|
Mientras que en el caso
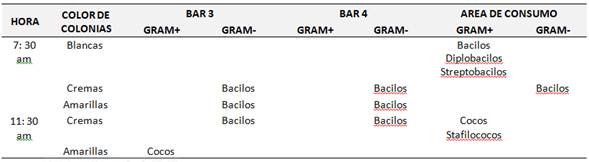
de Facultad de Ciencias Empresariales Tabla 2, se encontraron resultados similares con mayor presencia en horario de 7:30 am, donde en los Bar 3 y 4 con bacilos GRAM- y de color crema para
GRAM+ con bacilos, diplobacilos y estafilococos en el área de consumo.
Tabla 2. Monitoreo bacteriano en agar nutritivo en la Facultad
de Ciencias Empresariales.
Continuamos con las características de las bacterias en la Facultad de Ciencias
Sociales, con predominio de CEPAS de color crema, olor fuerte, forma irregular, borde entero,
textura cremosa y bacterias GRAM-
Tabla 3.
Tabla 3. Caracterización bacteriana en la Facultad de Ciencias Sociales.
|
N0 de CEPAS
|
COLOR
|
OLOR
|
FORMA
|
COLONIAS
BORDE
|
TEXTURA
|
BACTERIAS
|
|
1
|
Verde
|
Olor Fuerte
|
Circular
|
Entero
|
Cremosa
|
Bacilos Gram (-)
|
|
2
|
Crema
|
Característico
|
Circular
|
Entero
|
Cremosa
|
Cocos Gram (+)
|
|
3
|
Amarillo
|
Olor Fuerte
|
Irregular
|
Ondulado
|
Cremosa
|
Bacilos Gram (-)
|
|
4
|
Blanca
|
Característico
|
Circular
|
Entero
|
Cremosa
|
Bacilos Gram (+)
|
|
5
|
Verde
|
Olor Fuerte
|
Circular
|
Entero
|
Cremosa
|
Bacilos Gram (-)
|
|
6
|
Crema
|
Olor Fuerte
|
Irregular
|
Ondulado
|
Cremosa
|
Bacilos Gram (-)
|
|
N0 de CEPAS
|
COLOR
|
OLOR
|
FORMA
|
COLONIAS
BORDE
|
TEXTURA
|
BACTERIAS
|
|
7
|
Crema
|
Característico
|
Irregular
|
Ondulado
|
Cremosa
|
Estafilococos Gram (+)
|
|
8
|
Crema
|
Olor Fuerte
|
Puntiforme
|
Entero
|
Cremosa
|
Bacilos Gram (-)
|
|
9
|
Crema
|
Característico
|
Circular
|
Entero
|
Cremosa
|
Estafilococos Gram (+)
|
|
10
|
Crema
|
Característico
|
Irregular
|
Ondulado
|
Cremosa
|
Estafilococos Gram (+)
|
|
11
|
Crema
|
Olor Fuerte
|
Puntiforme
|
Entero
|
Cremosa
|
Bacilos Gram (-)
|
|
12
|
Blanca
|
Característico
|
Irregular
|
Ondulado
|
Cremosa
|
Cocos Gram (+)
|
|
13
|
Crema
|
Olor Fuerte
|
Puntiforme
|
Entero
|
Cremosa
|
Bacilos Gram (-)
|
|
14
|
Crema
|
Olor Fuerte
|
Circular
|
Entero
|
Cremosa
|
Bacilos Gram (-)
|
|
15
|
Crema
|
Olor Fuerte
|
Irregular
|
Ondulado
|
Cremosa
|
Bacilos Gram (-)
|
|
16
|
Blanca
|
Característico
|
Puntiforme
|
Entero
|
Cremosa
|
Cocos Gram (+)
|
|
17
|
Crema
|
Olor Fuerte
|
Irregular
|
Ondulado
|
Cremosa
|
Bacilos Gram (-)
|
|
18
|
Crema
|
Característico
|
Irregular
|
Lobulado
|
Cremosa
|
Bacilos, Streptobacilos Gram (+)
|
|
19
|
Amarillo
|
Olor Fuerte
|
Puntiforme
|
Entero
|
Cremosa
|
Bacilos Gram (-)
|
|
20
|
Crema
|
Olor Fuerte
|
Circular
|
Entero
|
Cremosa
|
Bacilos Gram (-)
|
|
21
|
Crema
|
Olor Fuerte
|
Puntiforme
|
Entero
|
Cremosa
|
Bacilos Gram (-)
|
|
22
|
Crema
|
Olor Fuerte
|
Irregular
|
Ondulado
|
Cremosa
|
Bacilos Gram (-)
|
Las bacterias
en la Facultad de Ciencias
Empresariales se caracterizaron por ser de color crema, olor fuerte,
forma irregular, borde entero, textura
cremosa y organismos GRAM-, Tabla 4.
Tabla 4. Caracterización bacteriana de la Facultad de Ciencias Empresariales.
|
N0 de CEPAS
|
COLOR
|
OLOR
|
FORMA
|
COLONIAS
BORDE
|
TEXTURA
|
BACTERIAS
|
|
1
|
Crema
|
Olor Fuerte
|
Irregular
|
Ondulado
|
Cremosa
|
Bacilos Gram (-)
|
|
2
|
Amarillo
|
Característico
|
Circular
|
Entero
|
Cremosa
|
Bacilos Gram (+)
|
|
3
|
Amarillo
|
Olor Fuerte
|
Circular
|
Entero
|
Cremosa
|
Bacilos Gram (-)
|
|
4
|
Crema
|
Olor Fuerte
|
Circular
|
Ondulado
|
Cremosa
|
Bacilos Gram (-)
|
|
5
|
Crema
|
Olor Fuerte
|
Irregular
|
Ondulado
|
Cremosa
|
Bacilos Gram (-)
|
|
6
|
Crema
|
Olor Fuerte
|
Irregular
|
Ondulado
|
Cremosa
|
Bacilos Gram (-)
|
|
7
|
Amarillo
|
Olor Fuerte
|
Irregular
|
Ondulado
|
Seca
|
Bacilos Gram (-)
|
|
8
|
Crema
|
Olor Fuerte
|
Irregular
|
Ondulado
|
Cremosa
|
Bacilos Gram (-)
|
|
9
|
Crema
|
Olor Fuerte
|
Circular
|
Entero
|
Cremosa
|
Bacilos Gram (-)
|
|
10
|
Crema
|
Olor Fuerte
|
Circular
|
Entero
|
Cremosa
|
Bacilos Gram (-)
|
|
11
|
Crema
|
Característico
|
Circular
|
Entero
|
Cremosa
|
Cocos, Stafilococos Gram (+)
|
|
12
|
Crema
|
Olor Fuerte
|
Puntiforme
|
Entero
|
Cremosa
|
Bacilos Gram (-)
|
|
13
|
Crema
|
Característico
|
Circular
|
Entero
|
Cremosa
|
Cocos Gram (+)
|
De acuerdo con lo identificado para Bar 1, en el área de mesas para preparar
alimentos las pruebas
bioquímicas resultaron positivas
en CITRATO, LISINA, SIM, CATALASA, OXIDASA, en TSI es alcalina
sin producir gas ni H2S y en UREA es negativa;
obteniendo como resultado
la presencia de Pseudomona aeruginosa, y
en tinción de gram se observó bacilos negativos. En el área de consumo Las colonias son de color amarillo,
presentan un olor fuerte, la forma de
las colonias es irregular con borde
ondulado y una textura cremosa. En las pruebas bioquímicas resultó positivo en LISINA,
SIM, CATALASA, en TSI es ácida, produce gas, sin producir H2S y en UREA, CITRATO y OXIDASA es negativa;
obteniendo como resultado
la presencia E. Coli, y en
tinción de gram se observó bacilos negativos
Tabla 4.
Para
las tablas de picar, resultó positivo en LISINA,
SIM, CATALASA, en TSI es ácida, produce gas, sin producir H2S y en UREA, CITRATO
y OXIDASA es negativa;
obteniendo como resultado la presencia
E. Coli, y en tinción de gram se observó bacilos negativos. Mientras que,
las colonias son de color crema,
presentan un olor fuerte, la forma de
las colonias es puntiforme con borde entero y
una textura cremosa. En las pruebas bioquímicas resultó positivo en LISINA, SIM, CATALASA, en TSI es ácida, produce gas, sin producir H2S y
en UREA, CITRATO y OXIDASA es negativa; obteniendo como resultado la
presencia E. Coli,
y en tinción de gram
se observó bacilos
negativos.
De acuerdo
a los identificado en el BAR 2 en el área de mesas para preparar alimentos
nos dio positivo en CITRATO, LISINA,
SIM, CATALASA, en TSI es alcalina/ácida, produce
gas y H2S y en UREA, y OXIDASA es negativa; dando como
resultado la presencia Salmonella, y
en cuanto a la tinción de gram que se observó bacilos
negativos.
Para el área identificamos negativa a CITRATO,
LISINA, SIM, UREA, y OXIDASA, en TSI es alcalina/ ácida, no produce gas ni H2S y en CATALASA es positiva;
dando como resultado
la presencia Shigella, y en cuanto a la tinción de gram
que se le realizó se observó bacilos
negativos.
Tabla 5. Caracterización bacteriana de la Facultad
de Ciencias Empresariales.

Amarillo:
Shigella; Turquesa:
Salmnella; Verde:
E. coli; Rojo: Pseudomona Aeruginosa; Rosado: Klebsiella
*C: Si es de color verde es negativo y si es de color azul es positivo para citrato.
*L: Si es de color morado es positivo y si es de color amarillo es negativo para lisina.
*S: Si hay turbidez y si se extiende más allá de la línea
de siembra en el agar es porque
hay motilidad en sim.
*T: Si el pico o fondo es de color rojo es alcalino, y si el pico o fondo es de color amarillo es ácido, si se ennegrece hay presencia de H2S y si hay burbujas o rompimiento del agar es porque hay gas en tsi.
*U: Si es de color amarillo es negativo y si es de color rosado es positivo para urea.
*Cat: Si hay presencia
de burbujas es positiva y si no hay es negativa para catalasa.
*O: Si la tirilla cambia
a color morado es positivo,
si no cambia es negativo
en oxidasa.
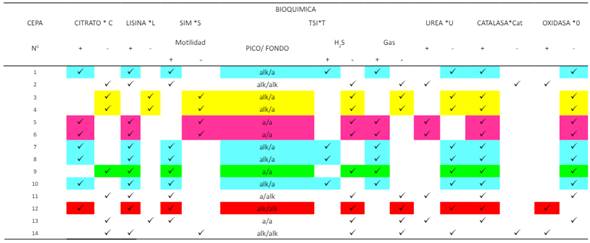
Tabla 6. Identificación bacteriana mediante las pruebas
bioquímicas en la Facultad de Ciencias Empresariales
*C:
Si es de color verde es negativo y si es de color azul es positivo para
citrato.
*L:
Si es de color morado es positivo y si es de color amarillo es negativo para
lisina.
*S:
Si hay turbidez y si se extiende más allá de la línea de siembra en el agar es
porque hay motilidad en sim.
*T:
Si el pico o fondo es de color rojo es alcalino, y si el pico o fondo es de
color amarillo es ácido, si se ennegrece hay presencia de H2S y si hay burbujas
o rompimiento del agar es porque hay gas en tsi.
*U:
Si es de color amarillo es negativo y si es de color rosado es positivo para
urea.
*Cat: Si hay presencia de burbujas es positiva y si no hay
es negativa para catalasa.
*O:
Si la tirilla cambia a color morado es positivo, si no cambia es negativo en
oxidasa.
En
el BAR 3 y área de mesas para preparar alimentos Tablas 6. En las pruebas
bioquímicas resultó positivo
en CITRATO, LISINA,
SIM, CATALASA, en TSI es
alcalina/ácida, produce gas y H2S y en UREA, y OXIDASA
es negativa; obteniendo como resultado la presencia Salmonella, y en tinción
de gram se observó bacilos
negativos.
En las tablas de picar en las pruebas
bioquímicas resultó negativa
CITRATO, LISINA, SIM, UREA, y OXIDASA, en TSI es alcalina/ácida, sin producir gas ni H2S y en CATALASA es
positiva; dando como resultado la
presencia Shigella, y en cuanto a la tinción de gram se observó
bacilos negativos. En el BAR 4 en el
área de mesas para preparar alimentos
resultó positivo en CITRATO, LISINA,
UREA, CATALASA, en TSI es ácida, produce gas, sin producir H2 S y en SIM y OXIDASA
es negativa; obteniendo como
resultado la presencia Klebsiella, y en tinción de gram
se observó bacilos negativos.
En la tabla de picar en el BAR 4 resultaron positivo en CITRATO, LISINA,
SIM, CATALASA, en TSI es alcalina/ácida, produce gas y H2S y en UREA, y OXIDASA es negativa; dando como resultado la presencia Salmonella, y en
tinción de gram
se observó bacilos negativos. En el área de consumo
resultó positivo en CITRATO, LISINA,
SIM, CATALASA, OXIDASA, en TSI es alcalina, sin producir gas ni H2 S y en UREA es
negativa; obteniendo como resultado la presencia de Pseudomona aeruginosa, y en
tinción de gram se
observó bacilos negativos.
Para la frecuencia Tabla 7, se determinó que en los mesones
hay la incidencia de bacterias
como Klebsiella, Pseudomona, las cuales están presentes con una mediana
frecuencia, E. coli
y Salmonella presentan una baja frecuencia bacteriana
en esta superficie. En la tabla de picar se
determinó una mayor frecuencia bacteriana de
Salmonella, una media frecuencia de E. coli y
una baja frecuencia de Shigella. Con respecto al área de consumo se determinó una mayor frecuencia bacteriana de E. coli, Shigella, una mediana frecuencia de Klebsiella
y una menor frecuencia por Pseudomona correspondiente a superficies inertes.
Tabla 7. Tabla
cruzada de las superficies inertes de los bares de la Universidad Técnica de Machala
y la frecuencia bacteriana.
|
Superficies Inertes Bacterias
Entericas
|
>F
|
BAR 1
MF
|
<F
|
>F
|
BAR 2
MF
|
<F
|
>F
|
BAR 3
MF
|
<F
|
>F
|
BAR 4
MF
|
<F
|
|
|
Mesón
|
E. coli
|
|
1
|
|
|
|
|
|
Salmonella
|
|
|
1
|
|
|
|
|
Shigella
|
|
|
1
|
|
|
|
|
Klebsiella
|
|
|
|
2
|
|
|
|
Pseudomona
|
2
|
|
|
|
|
|
Superficies Inertes Bacterias
Entericas
|
>F
|
BAR 1
MF
|
<F
|
>F
|
BAR 2
MF
|
<F
|
>F
|
BAR 3
MF
|
<F
|
>F
|
BAR 4
MF
|
<F
|
|
Tabla de Picar E. coli
|
2
|
|
|
1
|
|
Salmonella
|
|
1
|
|
3
|
|
Shigella
|
|
|
1
|
|
|
Klebsiella
|
|
|
|
|
|
Pseudomona
|
|
|
|
|
|
ÁREA DE CONSUMO
|
|
>F
|
SOCIALES
MF
|
<F
|
>F
|
EMPRESARIALES MF
|
<F
|
|
|
E. coli
|
3
|
|
|
|
|
|
|
|
Salmonella
|
|
|
|
|
|
|
|
|
Shigella
|
3
|
|
|
|
|
|
|
|
Klebsiella
|
|
2
|
|
|
|
|
|
|
Pseudomona
|
|
|
|
|
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Además se observa que la mayor incidencia de la frecuencia bacteriana según los Restaurantes de Facultad de Ciencias Sociales
(Bar 1 y 2) y la Facultad
de
Ciencias Empresariales (Bar 3 y 4) de la Universidad Técnica de Machala
que se analizaron se
evidenció que el Bar 4 presentó una mayor frecuencia de Salmonella y una mediana frecuencia de Klebsiella,
el Bar 1 obtuvo una mediana
frecuencia correspondiente a E. coli y Pseudomona, el Bar 2 y 3 tuvieron
una baja frecuencia en Salmonella y el Bar 3 también presenta
una baja frecuencia para Shigella. Al comparar la frecuencia bacteriana de las superficies inertes entre los restaurantes de la Facultad
de Ciencias Sociales
y Ciencias Empresariales, se determinó que los
restaurantes de Ciencias
Empresariales presentan mayor frecuencia bacteriana.
La frecuencia bacteriana según las áreas de consumo de alimentos determina, que el área de
consumo de la Facultad de Ciencias Sociales es la que tiene mayor y mediana frecuencia bacteriana de E. coli, Shigella y Klebsiella y
la Facultad de Ciencias Empresariales presenta una baja frecuencia de Pseudomona.
DISCUSIÓN
Las
ETA representan un importante problema de salud pública a nivel mundial
(9); entre los microorganismos principalmente involucrados como
contaminantes de alimentos se encuentran bacterias, parásitos, virus, hongos y levaduras, que pueden causar
el deterioro de los alimentos o enfermedades asociadas a su consumo (10). Las bacterias
implicadas en este tipo de enfermedades se clasifican en dos grupos,
el primero causante
de infecciones, que se
multiplican dentro del tracto gastrointestinal, sus principales representantes son Salmonella spp, Shigella spp, Vibrio parahemolycus, Yersinia enterocolitica, especies
termófilas de Campylobacter spp, Escherichia coli enteropatógena, Streptococcus spp, entre otros; (11) y el segundo grupo causantes
de intoxicación por producción de
toxinas como Bacillus cereus, Staphylococcus aureus y Clostridium botulinum (12).
En el presente estudio
realizado en las en superficies inertes (mesón, tabla de picar
y mesas) de los restaurantes de la
Universidad Técnica de Machala se encontró la presencia de bacterias entéricas
como: E. coli, Salmonella, Shigella, Pseudomona aeruginosa
y Klebsiella pneumoniae mediante los análisis microbiológicos,
indicando que existe una inadecuada
desinfección higiénico sanitaria por parte del personal. En sentido Marin- Méndez et al. (9) obtuvieron un
aislamiento de agentes bacterianos en
100,0 % de las muestras de alimentos. Hubo una mayor frecuencia de bacterias Gram negativas (82,0 %) y la menor correspondió
a microorganismos Gram positivos (18,0
%). La Salmonella D fue el microorganismo más frecuente. Por su parte
Hernández et al.
(13) donde los géneros
de Salmonella y Shigella presentaron fluctuaciones en el periodo
estudiado con un decremento importante en el 2014 debido a la
presencia de Vibrio cholerae, que ocasionó una epidemia y desplazó al resto de las bacterias patógenas intestinales.
De igual manera, en el estudio
realizado por Castañeda et al. (14) la presencia de Salmonella spp
en las muestras de pechugas de pollo evaluadas
fue alto, lo que implica un
riesgo potencial para la salud pública (15).
Mientras
que, Rodríguez-Julian et al. (16), al identificar los agentes causales que
influyen en la aparición de estas ETA
notificaron aislamiento de solo tipo de agente
bacteriano, con predominio de las bacterias gramnegativas, donde la Salmonella fue el microorganismo más identificado. Los principales
grupos de alimentos relacionados con la
aparición de dichos brotes
resultaron ser la carne y sus
derivados, así como la ensalada fría. Los
que enfatizan que la vigilancia epidemiológica
de brotes de enfermedades transmitidas por alimentos es de vital importancia, permitió
identificar el verdadero agente causal
en los brotes.
El riesgo de padecer
estas enfermedades es mayor
en los países de ingresos
bajo y mediano, y está vinculado con la preparación de alimentos con agua
contaminada, falta de higiene, condiciones inadecuadas en la producción y almacenamiento, bajo
nivel de alfabetismo y educación, así como insuficientes leyes en materia de inocuidad de
los alimentos o falta de aplicación (17). De acuerdo con lo que ha venido analizando, las ETA constituyen uno de los problemas de salud pública
más frecuentes en la vida cotidiana y provienen de las
diferentes etapas a lo largo de la cadena
alimentaria, desde la producción
primaria hasta la mesa. Así, a través de
los alimentos se transmite con gran facilidad
una cantidad considerable de
brotes de enfermedades. (18,19). La contaminación fecal en los animales
de sangre caliente es una fuente probable
de gérmenes patógenos humanos, entre los que se destacan
la Salmonella, el Campylobacter y la Escherichia
coli enterotoxigénica;
también se ha demostrado que es una
fuente importante de Listeria monocytogenes
(20).
En correspondencia con
esta afirmación, la OMS considera
a las ETA como uno de los problemas de salud pública
más extendidos en el mundo contemporáneo y se puede afirmar que constituyen una
causa muy importante
de morbilidad, que lejos de ser un problema del pasado, se ha convertido en un problema
emergente. La globalización de los mercados y la complejidad de la
cadena alimentaria hacen que la disponibilidad de alimentos seguros
sea una ardua tarea en el mundo,
pleno de patógenos, alérgenos o contaminantes ambientales, dado el incremento de brotes en los últimos
años, como lo describen Olea et al. (21).
De forma
general Pires
et al. (22)
se observaron al
identificar microorganismos en muestras de alimentos congelados y sin congelar
un aumento de la cantidad
y diversidad de bacterias en las
muestras sin refrigerar, confirmando que la cadena del frío retrasa
el desarrollo de microorganismos en los alimentos,
aumentando la vida útil de los mismos. Además, el estudio demuestra
la eficacia de la secuenciación masiva del ADNr16S para
estudiar el efecto de la
temperatura en el desarrollo de comunidades bacterianas sobre los alimentos.
De ahí que concluyan que la calidad y diversidad de microorganismos aumenta, de forma general, en los alimentos sin refrigerar, confirmando que la cadena del frío retrasa el desarrollo de microorganismos
en los alimentos, aumentando así la vida
útil de los mismos.
CONCLUSIONES
Se confirmó la presencia de bacterias entéricas
como: E. Coli, Salmonella, Shigella, Klebsiella y Pseudomona
Aeruginosa, en áreas de preparación (mesón y tabla de picar) y consumo de alimentos (mesas)
en restaurantes de la Universidad Técnica de Machala.Las frecuencias bacterianas en las superficies inertes
de los restaurantes de la Universidad Técnica
de Machala son E. coli, Salmonella y Shigella.
El personal
que conforma la Unidad de Bienestar
Estudiantil se comprometió al control
de la seguridad alimentaria y nutricional de la institución, además de la elaboración de un instructivo sobre las buenas prácticas
higiénicas sanitarias que se deben llevar a cabo en cada una de las áreas de estudio
y en todos los restaurantes de la Universidad Técnica de Machala.
CONFLICTO
DE INTERESES. Los
autores manifiestan que no existe
conflicto de intereses para la publicación del presente artículo científico.
FINANCIAMIENTO. Los autores declaran
no recibieron financiamiento
AGRADECIMIENTO. Los autores reflejan
el esfuerzo y el aporte
que las personas aportaron al desarrollo del presente artículo
científico.
REFERENCIAS BIBLIOGRÁFICAS
1. Arteaga V, Indio J, Soledispa L, Cedeño N. Control ambiental de enfermedades metaxénicas en Ecuador.
Dominio de las Ciencias. 2021. 7(4):
130. https://n9.cl/fbajtv
2. Núñez G, Herrera F, Copa E, Jaramillo M. Manejo higiénico de los alimentos
y enfermedades de transmisión alimentaria. Boletín de malariología y salud ambiental. 2022. 62(4): 804-811.
https:// n9.cl/kcjsw
3.
Guambi D, Muñoz A, Castro
I, Antamba E. La potencialidad de las enfermedades transmitidas por
alimentos (ETA´ S) en los conceptos y estilos
culinarios: Una Revisión. FACSalud UNEMI. 2022. 6(11): 66-75.
https://n9.cl/u0h2f5
4.
Fernández S, Marcía J, Bu J,
Baca Y, Chávez V, Montoya H, Ore F. Enfermedades transmitidas por Alimentos (Etas);
Una Alerta para el consumidor. Ciencia
Latina Revista Científica Multidisciplinar. 2021. 5(2): 2284-2298. https://n9.cl/5w30f
5. Chiriboga M, Jachero V, García L. Enfermedades transmitidas por bacterias
patógenas presentes en los alimentos en América del Sur,
artículo de revisión. Conciencia
Digital. 2023. 6(3.1): 117-141. https://n9.cl/zelkt
6. NTE INEN 1
529-2:99. NTE
INEN
1529-2.
Control
Microbiológico de Los Alimentos. Toma, Envío
y Preparación de Muestras Para El Análisis Microbiológico. 1999, pp. 2. https://n9.cl/nlezu
7.
MINSA. Guía Técnica
Para El Análisis Microbiológico de Superficies En Contacto Con Alimentos y Bebidas. 2007, 461, 1–15. https:// n9.cl/76dhi
8.
Sáenz T, Santa A. Microbiología básica coloraciones de bacterias y bioquímica en los medios de cultivos. Editorial: imprenta
unión de la universidad Peruana
Unión. Perú. 2004
9.
Marin-Mendez M, Rodríguez-Julian A, Minier- Pouyou L, Zayas-Tamayo E, Soler-Santana R. Caracterización de agentes bacterianos aislados en brotes de enfermedades transmitidas por alimentos. MEDISAN. 2020. 24(2):235-251. https://n9.cl/0fjayx
10. Puig-Peña
Y, Leyva V,
Robert B,
Pérez Y.
Agentes bacterianos asociados a brotes de
enfermedades transmitidas por
alimentos en La Habana, 2006- 2010. Rev Cubana Hig Epidemiol. 2013. 51(1):74–
83. https://n9.cl/w4l91
11.
Carrillo-Inungaray M, López-González R, Alvarado-Sánchez B, Aguilar-Zárate M. Comparación De Los Métodos
Fenotípico Y Molecular
Para Identificación De Patógenos En Alimentos. Rev Acad Investig. 2011. 7:1–20. https://n9.cl/hcugx
12.
De Toledo C E. Principais bactérias presentes em doenças transmitidas por alimentos (DTAs). Brazil: Universidade Federal
Do Rio Grande Do Sul; 2011. https://n9.cl/kem2f
13.
Hernández C, Vázquez-Hernández G, Mesa- Delgado
Z, Bermúdez-Alemán RI, Sotolongo- Rodríguez Y, Vázquez-Hernández G. Bacterias enteropatógenas asociadas
a enfermedad diarreica aguda en niños. Acta Médica del Centro.
2017. 11(2). https://n9.cl/s35qs
14.
Castañeda R, Pereira
A, Pulido A, Mendoza
M. Estimación de la prevalencia de Salmonella spp. en pechugas de pollo para consumo humano provenientes de cuatro localidades de Bogotá- Colombia.
Infect. 2019. 23(1): 27-32. https://n9.cl/ sjglk
15.
Huertas-Caro C, Urbano-Cáceres E, Torres- Caycedo M.
Diagnóstico molecular una alternativa para la detección de patógenos en alimentos. Revista
Habanera de Ciencias
Médicas. 2019. 8(3):513-528. https://n9.cl/1j8qh1
16.
Rodríguez-Julian A, Marin-Mendez M, Minier-Pouyou L, Rizo-Arredondo I, Fuentes- Gómez. Vigilancia epidemiológica de brotes de enfermedades trasmitidas por alimentos en la provincia de Santiago de Cuba. MEDISAN.
2022. 26(1):47-59. https://n9.cl/15srn
Montenegro
M, Osorio P. Comportamiento de las enfermedades transmitidas por alimentos
y estrategias de mejoramiento en cuatro municipios del Quindio, Colombia. Riuq. 2019. 31(1): 1-12. https://n9.cl/fqqj4s
17.
Zamora-Intriago I, Barbosa Y. Los riesgos de manipulación de los alimentos
funcionales y su importancia para la salud. Correo Cient. Méd. 2019. 23(3): 1-10.
https://n9.cl/0r9l6
18.
Galarza K. Evaluación microbiológica de alimentos adquiridos en la vía pública del
cercado de Lima entre mayo 2017 y junio 2018. Lima: Facultad de Farmacia y Bioquímica; 2018.
https:// n9.cl/msrc3
19. Valenzuela
R, González A,
Montes R.
Evaluación de
Campylobacter spp.
en carne y
vísceras de cerdo y pollo por diferentes métodos
microbiológicos y moleculares.
Valencia: Universidad Politécnica de Valencia; 2019.
https://n9.cl/61tzv
20. Olea A, Díaz J, Fuentes R, Vaquero A, García M. Vigilancia de brotes de enfermedades transmitidas por alimentos en Chile. Rev. Chil. Infectol. 2012. 29(5). https://n9.cl/1s9s4
21.
Pires V, Rivas R, García-Fraile P. Análisis metagenómico de la evolución
de Las comunidades microbianas en alimentos Sometidos a refrigeración y en condiciones de ausencia de frío FarmaJournal. 2019. 4(2): 73-84.
https://n9.cl/5499n
VIVE. Revista de Investigación en
Salud