 VIVE.
Revista de Investigación en Salud
VIVE.
Revista de Investigación en Salud
https://revistavive.org
Volumen 7
No. 19, enero-abril 2024
ISSN:
2664-3243
ISSN-L:
2664-3243
pp. 23 – 39

Hemoglobina
reticulocitaria en el diagnóstico precoz de la anemia por deficiencia de hierro
Reticulocyte
hemoglobin in the early diagnosis of iron deficiency anemia
Hemoglobina de
reticulócitos no diagnóstico precoce da anemia por deficiência de ferro
José
Zacarías Rendón Párraga1
zacariasrendon@hotmail.com
https://orcid.org/0000-0001-6868-8137
Matías Arana2
marana@stamboulian.com.ar
https://orcid.org/0009-0005-1677-8233
1Universidad
Técnica de Manabí. Portoviejo, Perú.
2Centro
de Estudios Infectologicos S.A. Stamboulian Servicios de Salud. Buenos Aires,
Argentina
Artículo recibido 24 de
octubre 2023 | Aceptado 14 de diciembre 2023 | Publicado 15 de enero 2024

Escanea en tu dispositivo móvil o
revisa este artículo en:
https://doi.org/10.33996/revistavive.v7i19.280
RESUMEN
La anemia
por deficiencia de hierro es un problema prevalente a nivel global que aparece
en niños, adolescentes y mujeres en edad fértil, son los más afectados. La
hemoglobina reticulocitaria es un nuevo biomarcador prometedor para el
diagnóstico temprano. Objetivo. Evaluar la hemoglobina reticulocitaria
para el diagnóstico precoz de anemia por deficiencia de hierro. Metodología.
Se realizó una revisión sistemática en bases de datos biomédicas como PubMed,
Scielo, Researchgate, Base, Cochrane Library y DOAJ; se incluyeron 24 estudios
observacionales (2018-2023) sobre el uso de la hemoglobina reticulocitaria en
el diagnóstico de anemia por deficiencia de hierro; se extrajeron datos sobre
las características de los estudios, los valores de sensibilidad y
especificidad de este biomarcador. Resultados. La hemoglobina
reticulocitaria presentó una sensibilidad agrupada de 90% y una especificidad
de 89,5% en los estudios analizados. También mostró una diferencia de medias
significativa de -2,88 (IC 95%: -3,36 a -2,40) entre grupos con y sin anemia
por deficiencia de hierro. Se encontró una heterogeneidad sustancial entre los
resultados de los diferentes estudios (I2=95%; p<0,00001). Conclusión.
La hemoglobina reticulocitaria demostró elevada sensibilidad y especificidad,
así como una diferencia significativa entre grupos con y sin la condición, lo
que evidencia su utilidad como prueba para la detección temprana de la anemia
por deficiencia de hierro.
Palabras clave: Biomarcador; Diagnóstico;
Eritropoyesis
ABSTRACT
Iron deficiency anemia is a prevalent global health problem that appears
in children, adolescents and women of childbearing age, who are the most
affected. Reticulocyte hemoglobin is a promising new biomarker for early
diagnosis. Objective. To
evaluate reticulocyte hemoglobin for the early diagnosis of iron deficiency
anemia. Methodology. A systematic review
was conducted searching biomedical databases including PubMed, Scielo,
Researchgate, Base, Cochrane Library and DOAJ; 24 observational studies
(2018-2023) were included on the use of reticulocyte hemoglobin in the
diagnosis of iron deficiency anemia; data were extracted on the characteristics
of the studies and the sensitivity and specificity values of this biomarker.
Results.
Reticulocyte hemoglobin showed a pooled sensitivity of 90% and a specificity of
89.5% in the studies analyzed. It also showed a significant mean difference of
-2.88 (95% CI: -3.36 to -2.40) between groups with and without iron deficiency
anemia. Substantial heterogeneity was found among the results of the different
studies (I2=95%; p<0.00001). Conclusion.
Reticulocyte hemoglobin demonstrated high sensitivity and specificity, as well
as a significant difference between groups with and without the condition,
which shows its usefulness as a test for the early detection of iron deficiency
anemia.
Keywords: Erythropoiesis; Diagnosis; Biomarker
RESUMO
A anemia por deficiência de ferro é um problema de saúde global
prevalente que aparece em crianças, adolescentes e mulheres em idade fértil,
sendo os mais afetados. A hemoglobina reticulocitária é um novo biomarcador
promissor para o diagnóstico precoce. Objetivo. Avaliar a hemoglobina
reticulocitária para o diagnóstico precoce da anemia por deficiência de ferro. Metodologia.
Foi realizada uma revisão sistemática com busca em bases de dados biomédicas
incluindo PubMed, Scielo, Researchgate, Base Cochrane Library e DOAJ; foram
incluídos 24 estudos observacionais (2018-2023) sobre o uso da hemoglobina
reticulocitária no diagnóstico de anemia por deficiência de ferro; foram
extraídos dados sobre as características dos estudos e os valores de sensibilidade
e especificidade deste biomarcador. Resultados. A hemoglobina
reticulocitária apresentou sensibilidade agrupada de 90% e especificidade de
89,5% nos estudos analisados. Também mostrou uma diferença média significativa
de -2,88 (IC 95%: -3,36 a -2,40) entre grupos com e sem anemia por deficiência
de ferro. Encontrou-se heterogeneidade substancial entre os resultados dos
diferentes estudos (I2=95%; p<0,00001). Conclusão. A hemoglobina
reticulocitária demonstrou elevada sensibilidade e especificidade, bem como uma
diferença significativa entre grupos com e sem a condição, o que evidencia a
sua utilidade como teste para a detecção precoce da anemia por deficiência de
ferro.
Palavras-chave:
Eritropoiese; Diagnóstico; Biomarcador
INTRODUCCIÓN
La
anemia por deficiencia de hierro (IDA) aparece en todas las edades sin
excepción, pero los niños, adolescentes y mujeres en edad fértil, se encuentran
dentro del grupo más afectado (1). También se la reconoce como una
afección clínica que puede afectar a pacientes que acuden a diversas
especialidades médicas y quirúrgicas, especialmente a aquellos con enfermedades
crónicas y ancianos (2).
La IDA se produce cuando la ingesta de hierro en el
humano es inferior a su excreción, de esta manera se produce un balance de
hierro negativo en el organismo (3). También están incluidos el embarazo,
la pérdida de sangre, la enfermedad renal, el sangrado menstrual abundante, la
enfermedad inflamatoria intestinal, la cirugía bariátrica o trastornos
genéticos extremadamente raros (4).
La anemia es un importante problema de salud
pública en el mundo, pero varía según el país, de 1990 a 2019 los índices
incrementaron, particularmente en los países menos desarrollados (5). La IDA es la deficiencia de
micronutrientes más común que afecta a casi un tercio de la población y es la
principal causa de anemia en todo el mundo (6).
A pesar de la naturaleza multifactorial de la enfermedad, la deficiencia de
hierro en la dieta sigue siendo la principal causa de anemia en todas las
regiones (5).
Se observó una incidencia de anemia fue más baja en los Estados Unidos y Canadá
de entre 4.5% a 18.0% (7).
En Asia Central 64.7%, Asia del Sur 54.8%, América Latina 62.3%, África 45,6 %
al 71,9 %, una proporción muy alta de la carga de anemia fue causada por IDA (6).
Se estima que 1.24 mil millones de personas
experimentan IDA en los últimos 10 años, aunque con grandes variaciones de los
países de ingresos bajos a los de ingresos altos (6,8).
Según el Global Burden of Disease Study la IDA es una de las 5 principales
causas de años vividos con discapacidad siendo más frecuente en mujeres (9).
Datos
recientes de la Organización Mundial de la Salud (OMS) sugieren que la anemia
afecta a alrededor de 800 millones de niños y mujeres, siendo la IDA la más
común (10).
La reducción de la anemia es una prioridad clave de la
Asamblea Mundial de la Salud Nutrición global Objetivos para 2025 y de los
objetivos de desarrollo sostenible (11). La IDA se asocia con resultados de
desarrollo cognitivo y motor deficientes en niños, puede causar fatiga y baja
productividad (12). Además, varias enfermedades crónicas
se relacionan con IDA, en particular, la enfermedad renal crónica, la
insuficiencia cardíaca crónica, el cáncer y la enfermedad inflamatoria
intestinal (10). Por tanto, es necesario un
diagnóstico precoz para evitar las secuelas asociadas, esto solo se puede
lograr con una mayor conciencia de la prevalencia y las causas de la IDA (13).
Entre los parámetros tradicionalmente utilizados
para evaluar la IDA se encuentran el hierro soluble en sangre, el hierro en
almacenamiento de ferritina y la saturación de transferrina (14). Sin embargo, estos parámetros se ven
afectados por ciertas condiciones y no es fácil evaluarlos, especialmente
durante una reacción de fase aguda y en presencia de anemia por enfermedades
crónicas (ACD) (15). Factores como la inflación,
malignidad, enfermedades hepáticas y el consumo de alcohol aumentan
independientemente del hierro (16). Por otro lado, debido a la vida útil
de los glóbulos rojos (120 días), estos parámetros tienen un gran retraso en su
respuesta (15).
Por ello la Hemoglobina Reticulocitaria (CHr) proporciona una evaluación en
tiempo real del estado del hierro y caracteriza la síntesis de la hemoglobina (17).
La hemoglobina de reticulocitos medida
como Chr o RET-He, nombres patentados de los fabricantes de analizadores de
hematología Siemens Healthineers (Erlangen, Alemania) y Sysmex (Kobe, Japón),
respectivamente (18,19).
Por lo tanto, una medición de la CHr
refleja el metabolismo real del hierro de la eritropoyesis y permite evaluar la
calidad de las células (20). Los cambios en el estado de hierro
de la eritropoyesis pueden así detectarse mucho antes que, determinando
únicamente el contenido de hemoglobina de los eritrocitos maduros (17). De esta manera, es muy importante
usarlo de forma rutinaria para el prediagnóstico de IDA, ya que el CHr es un
mejor biomarcador que las pruebas tradicionales para determinar IDA (21).
Los avances del hemograma automatizado han permitido el mejoramiento en el
desempeño analítico de esta prueba, sino la inclusión de nuevos parámetros con
importancia clínica, como lo es la Chr (19).
Diversas
investigaciones previas han sugerido que la Chr podría detectar depleción de
hierro de manera más temprana que otros marcadores, permitiendo un diagnóstico
oportuno de casos leves o moderados de IDA (21,22).
No obstante, se requiere una evaluación integral y sistemática de la evidencia
disponible para confirmar la utilidad clínica de la Chr como prueba diagnóstica
en etapas iniciales.
El
incremento en los casos de anemias ha generado el interés de este estudio el
cual tiene como propósito de evaluar la Chr en el diagnóstico precoz de la IDA.
Los resultados de este estudio aportarán a establecer el valor potencial de
este nuevo marcador dentro de la práctica clínica.
METODOLOGÍA
Se realizó una revisión sistemática en una búsqueda en las
bases de datos PubMed, Scielo, Researchgate, Base, Cochrane Library y DOAJ. Se utilizaron los términos "reticulocyte
hemoglobin" AND "iron deficiency anemia" OR "iron
deficiency" sin límites de fecha inicial. Los criterios de inclusión
fueron: a) La CHr utilizada como biomarcador en el diagnóstico de la IDA; b)
cohortes prospectivas/retrospectivos, de casos y controles; c) Artículos
publicados en inglés desde el 2018 hasta 2023.
Los criterios de exclusión fueron: d)
artículos repetidos, revisiones, informes de casos, opiniones de expertos,
cartas, editoriales, estudios en animales, y estudios sin grupo control; e)
estudios donde Chr no está relacionada con deficiencia de hierro, sin datos
disponibles, y sobre resultados diferentes a medias y desviaciones estándar; y
f) artículos en idiomas diferentes al inglés y estudios con grupos de pacientes
crónicos con anemia por deficiencia de hierro.

Figura 1. Flujograma para la identificación de bases de datos y
registros bajo el protocolo PRISMA
Se siguió un proceso de selección basado en el diagrama de flujo PRISMA (23). Se aplicó la Identificación de 6786, se tamizaron con los
términos de búsqueda un total de 567, Mediante los criterios de inclusión y
exclusión se seleccionó un total de 24 artículos (Figura 1).
Los datos extraídos incluyeron características de los participantes,
pruebas diagnósticas utilizadas, valores de sensibilidad, especificidad, medidas
de rendimiento diagnóstico de la Chr (Tabla 1). En cuanto a la evaluación de
calidad metodológica fue mediante la escala de sesgo cochrane risk of bias
tool, se establecieron los domidios: Selección de la muestra, diseño del
estudio, recopilación de datos, análisis estadístico, reporte de resultados,
aplicabilidad de la prueba (Figura 2).

Figura
2. Escala de sesgo
cochrane risk of bias tool.
Para el metaanálisis cuantitativo se utilizó el software RevMan 5.4.1
Inicialmente se evaluó la heterogeneidad mediante el estadístico I2, dada la
presencia de heterogeneidad considerable entre los estudios, se optó por
utilizar un modelo de efectos aleatorios en el metaanálisis modelo de efectos
aleatorios permitió incorporar la variabilidad entre estudios en la estimación,
proporcionando intervalos de confianza más amplios.
Se estimaron los intervalos de confianza al 95% para la diferencia de
medias de la Chr entre grupos y se realizó la prueba Z para evaluar la
significación estadística (p<0.05). La heterogeneidad se cuantificó con la
prueba I2. Se generó un gráfico de forest plot incluyendo estudios con grupos
control y con anemia por deficiencia de hierro.
DESARROLLO Y DISCUSIÓN
La presente revisión sistemática
resume los hallazgos de la tabla 1 que incluyen 24 estudios que evaluaron el desempeño diagnóstico de la Chr para la detección
de anemia por deficiencia de hierro, con un diseño retrospectivo o
prospectivos, en poblaciones de adultos (14 estudios) y mujeres embarazadas,
niños y recién nacidos (10 estudios); los tamaños muestrales variaron entre 50
a 1239 participantes y se emplearon diversos equipos hematológicos para la
medición de Chr, siendo los más frecuentes Sysmex (13 estudios) y Advia (4
estudios), evaluando parámetros como hemoglobina, volumen corpuscular medio,
ferritina sérica, saturación de transferrina e hierro sérico. La sensibilidad
de la Chr para el diagnóstico de IDA presentó un amplio rango entre 33,8% y
100%, con la mayoría de estudios reportando valores ≥90%, mientras que la
especificidad varió entre 50,4% y 100%, con la mayoría ≥80%.
Los estudios
incluyeron tanto participantes sanos como pacientes con diversas condiciones,
para evaluar el desempeño de la Chr en el diagnóstico de IDA. Varios incluyeron
adultos con diferentes condiciones, como: enfermedad renal crónica (2
estudios), talasemia, hipotiroidismo, anemia inflamatoria, colitis ulcerativa
de (1 estudio
cada uno), mujeres embarazadas, donantes de sangre, pacientes en
hemodiálisis y mujeres gestantes.
La evidencia en estas
poblaciones es útil para determinar la utilidad del biomarcador, cuando la
detección de IDA puede ser más compleja por la comorbilidad e incluso donde un
diagnóstico certero es esencial.
Es importante
mencionar que, para la identificación de los pacientes con IDA se realizó
principalmente a través de la medición de hemoglobina eritrocitaria. Niveles
bajos de este parámetro fueron utilizados como criterio diagnóstico inicial en
los grupos de casos, previo a la evaluación de la Chr. Por lo tanto, la
selección de estos pacientes se fundamentó en primera instancia en la detección
de anemia por deficiencia de hierro mediante mediciones de hemoglobina
eritrocitaria, para luego analizar el desempeño de la Chr (Tabla1)
* IDA,
Anemia por deficiencia de hierro; ERC, Enfermedad renal crónica; ACDC, Anemia de
enfermedad crónica; ID, Insuficiencia de hierro; Hb, Hemoglobina; VCM, Volumen
corpuscular medio; MCHC, Concentración de hemoglobina corpuscular media; Chr,
Hemoglobina reticulocitaria; AI, Anemia inflamatoria; RT-He, Reticulocyte
hemoglobin equivalent; UCIN, Unidad de cuidados intensivos neonatales; P.C.R,
Proteína C reactiva; Tsat%, Saturación de transferrina; Fe, Hierro sérico.
Sin embargo, mediante un metaanálisis de estos mismos estudios,
agrupando los datos de sensibilidad y especificidad individuales, al agruparlas
fueron de 90% y 89.5% respectivamente, consideradas altas. Es fundamental
resaltar que el área bajo la curva ROC (AUC-ROC) obtenida para la Chr es de
0.90.
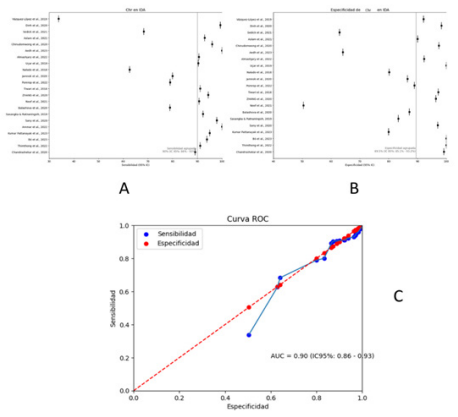
Figura 3. Desempeño de la Chr en el diagnóstico
de IDA (A) Sensibilidad agrupada, (B) Especificidad agrupada, (C) Curva ROC.
Este valor al estar muy cercano a 1, enfatiza de manera significativa la
excepcional capacidad de la Chr para el diagnóstico de la IDA. Los valores de AUC-ROC
próximos a 1 indican una habilidad sobresaliente para distinguir entre
pacientes con y sin la condición evaluada (Figura 3).
En cuanto a la diferencia entre los grupos, específicamente, la Chr
mostró una diferencia de medias (-2.88; IC 95%: -3.36 a -2.40) entre los grupos
de individuos con y sin IDA en los estudios incluidos. Se observó
heterogeneidad estadísticamente significativa entre los estudios incluidos para
la Chr (I2=95%; p<0,00001) Estos resultados refuerzan la confianza en la
capacidad de la Chr para detectar alteraciones tempranas en las eritropoyesis
asociadas a la deficiencia de hierro, lo que puede resultar fundamental para un
diagnóstico de la IDA. Así, la determinación de Chr permite detectar de forma
más temprana las alteraciones en las eritropoyesis asociadas a deficiencia de
hierro, en etapas iniciales donde otros marcadores aún no se alteran. Por
tanto, la incorporación de la Chr optimizaría la detección oportuna de IDA
(Figura 4).
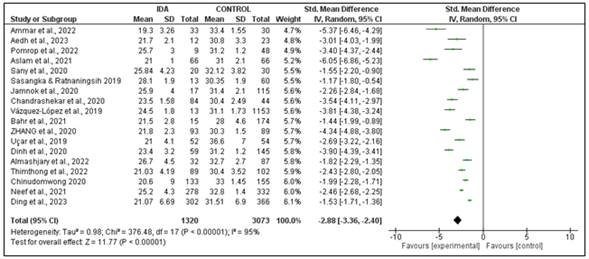
Figura 4. Forest plot de
diferencias de grupos de la chr en el diagnóstico de IDA
DISCUSIÓN
Esta revisión sistemática se estableció para la Chr en diagnóstico de IDA
una sensibilidad agrupada de 90% y una especificidad agrupada de 80.5% estos
datos son comparable a lo reportado por Kılıç et al (21) donde sostienen una sensibilidad y
especificidad agrupadas de 91.8% y 89.53% respectivamente, en cuanto a la
diferencia de medias agrupadas de nuestro estudio fue de -2,88 entre grupos con
y sin anemia por deficiencia de hierro, en el estudio por Kılıç et al fue de
-2,84 resaltando
así su capacidad para distinguir entre sujetos con y sin IDA.
Al igual que en nuestro estudio el de Kılıç et al, se observó una
heterogeneidad sustancial entre estudios incluidos sobre la Chr (I2=97%). Esta
inconsistencia en los resultados podría deberse a diferencias en las
características de las poblaciones y en las metodologías empleadas para la
medición de la Chr en cada investigación. Se necesitan más estudios para
determinar la utilidad de este marcador en distintos grupos poblacionales.
En cuanto a diferencias por grupos etarios, la revisión sistemática de
Powers et al (16) evidenció que la Chr permite detectar deficiencia
de hierro de manera más temprana que otros marcadores en niños. Sin embargo,
Joosten et al (48) concluyeron que no hay suficiente evidencia de la
superioridad de la Chr en adultos mayores, requiriéndose más investigaciones en
este grupo poblacional.
La evidencia actual respalda la incorporación de la Chr en la evaluación
de pacientes con sospecha de IDA. Si bien se requiere más investigación para
determinar su desempeño comparativo con otros marcadores, la medición de Chr
podría optimizar la detección oportuna de eficiencia de hierro y mejorar los
resultados clínicos.
CONCLUSIONES
Los
resultados de esta revisión sistemática indican que la Chr presenta una elevada
sensibilidad y especificidad con una diferencia de medias significativa que
demuestra su utilidad como una prueba detección oportuna de deficiencia de
hierro. Por lo tanto, dada la evidencia disponible, se recomienda incorporar de
forma rutinaria la Chr en la práctica clínica para la evaluación de pacientes
con sospecha de esta condición, ya que su implementación podría mejorar y
acelerar el diagnóstico permitiendo la identificación precoz de casos leves o
moderados.
Se necesitan
más investigaciones estandarizadas para establecer puntos de corte adecuados en
diferentes grupos poblacionales. Se estima realizar futuros estudios que
comparen directamente la Chr con diversos grupos etarios y según condiciones
que potencialmente alteren los parámetros hematológicos.
Conflicto de Intereses. Ninguno declarado por los Autores
Financiamiento. Ninguna declarada por los autores.
Agradecimientos. Facultad de posgrado de la Universidad
Técnica de Manabí.
REFERENCIAS
BIBLIOGRÁFICAS
1.
Martínez-Villegas O, Baptista-González H. Anemia por deficiencia de hierro en
niños: un problema de salud nacional Anemia due to iron deficiency in children:
a national health problem. Rev Hematol
Mex. 2019; 20(2): 96–105. https://doi.org/10.24245/rhematol
2. Cappellini M, Musallam K, Taher A. Iron deficiency anaemia revisited. Journal of Internal Medicine. Blackwell
Publishing Ltd; 2020. 287 (1) 153–170.
https://doi.org/10.1111/joim.13004
3. Baker R, Greer F, Bhatia J, Abrams S, Daniels S, Schneider M. Clinical
report - Diagnosis and prevention of iron deficiency and iron-deficiency anemia
in infants and young children (0-3 years of age). Pediatrics.
2010; 126(5):1040–1050. https://doi.org/10.1542/peds.2010-2576
4. Elstrott B, Khan L, Olson S, Raghunathan V, DeLoughery T, Shatzel J. The role of iron repletion in adult iron deficiency anemia and
other diseases. Eur J Haematol. 2020; 104(3):153–161.
https://onlinelibrary.wiley.com/doi/10.1111/ejh.13345
5. Safiri S, Kolahi A, Noori M, Nejadghaderi S, Karamzad N, Bragazzi N.
Burden of anemia and its underlying causes in 204 countries and territories,
1990–2019: results from the Global Burden of Disease Study 2019. J Hematol Oncol. 2021; 14(1): 2-16.
https://doi.org/10.1186/s13045-021-01202-2
6. Kassebaum N, Jasrasaria R, Naghavi M, Wulf S, Johns N, Lozano R, et al.
A systematic analysis of global anemia burden from 1990 to
2010. Blood. 2014; 123(5):615–624.
https://doi.org/10.1182/blood-2013-06-508325
7. Gupta P, Hamner H, Suchdev P, Flores-Ayala R, Mei Z. Iron status of
toddlers, nonpregnant females, and pregnant females in the United States. Am J Clin Nutr. 2017; 106 (2): 1640-1646.
https://doi.org/doi: 10.3945/ajcn.117.155978
8. Bellakhal S, Ouertani S, Antit S, Abdelaali I, Teyeb Z, Dougui M. Iron
deficiency anemia: clinical and etiological features. Tunis Med. 2019
97(12):1389-1398. https://pubmed.ncbi.nlm.nih.gov/32173810/
9. Vos T, Abajobir A, Abate K, Abbafati C, Abbas K, Abd-Allah F, et al.
Global, regional, and national incidence, prevalence, and years lived with
disability for 328 diseases and injuries for 195 countries, 1990–2016: a
systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 2017 ;390(10100):1211–1259.
https://linkinghub.elsevier.com/retrieve/pii/S0140673617321542
10. World Health Organization. Nutritional anaemias: tools for effective
prevention and control nutritional anaemias: tools for effective prevention and
control. 2017.
https://apps.who.int/iris/bitstream/handle/10665/259425/9789241513067-eng.pdf
11. WHO. Global nutrition targets 2025: anaemia policy brief
(WHO/NMH/NHD/14.4). Geneva: World Health Organization. 2014.
https://www.who.int/publications/i/item/WHO-NMH-NHD-14.4
12. Balarajan Y, Ramakrishnan U, Özaltin E, Shankar A, Subramanian S.
Anaemia in low-income and middle-income countries. The
Lancet. 2011; 378(9809). 2123-2135.
https://doi.org/10.1016/S0140-6736(10)62304-5
13. Cappellini M, Musallam K, Taher A. Iron deficiency anaemia revisited. Journal of Internal Medicine. 2020; 287(2), 153-170.
https://doi.org/10.1111/joim.13004
14. Hoenemann C, Ostendorf N, Zarbock A, Doll D, Hagemann O, Zimmermann M,
Luedi, M. Reticulocyte and Erythrocyte Hemoglobin Parameters for Iron
Deficiency and Anemia Diagnostics in Patient Blood Management. A Narrative Review. Journal of Clinical
Medicine. 2021; 10(18),4250.
https://doi.org/10.3390/jcm10184250
15. Jimenez K, Kulnigg-Dabsch S, Gasche C. Management of Iron Deficiency
Anemia. Gastroenterol Hepatol (Nueva York).
2015;11(4): 241-250.
https://pubmed.ncbi.nlm.nih.gov/27099596/
16. Powers J, Buchanan G, Adix L, Zhang S, Gao A, McCavit T. Effect of
low-dose ferrous sulfate vs iron polysaccharide complex on hemoglobin
concentration in young children with nutritional iron-deficiency anemia a
randomized clinical trial. JAMA - Journal of the American Medical Association.
2017; 317(22):2297-2304. https://doi.org/10.1001/jama.2017.6846
17. Nii M, Okamoto T, Sugiyama T, Aoyama A, Nagaya K. Reticulocyte
hemoglobin content changes after treatment of anemia of prematurity. Pediatrics International. 2022; 64(1).
Disponible en: https://doi.org/10.1111/ped.15330
18. Brugnara C, schiller b, moran j. Reticulocyte hemoglobin equivalent
(Ret He) and assessment of iron-deficient states. Clin Lab
Haematol. 2006; 28(5):303–308.
https://doi.org/10.1111/j.1365-2257.2006.00812.x
19. Buttarello M, Temporin V, Ceravolo R, Farina G, Bulian P. The New Reticulocyte Parameter (RET-Y) of the Sysmex XE 2100.
Am J Clin Pathol. 2004; 121(4):489–495.
https://pubmed.ncbi.nlm.nih.gov/15080300/
20. Hönemann C, Hagemann O, Doll D. Retikulozyten-Hämoglobin-Äquivalent als diagnostischer Marker der aktuellen Eisendefizienz. Anestesista. 2020; 69 (1) 919–925.
https://doi.org/10.1007/s00101-020-00870-y
21. Kılıç M, Özpınar A, Serteser M, Kilercik M, Serdar M. The effect of
reticulocyte hemoglobin content on the diagnosis of iron deficiency anemia: a
meta-analysis study. J Med Biochem. 2022; 41(1):1–13.
https://doi.org/10.5937/JOMB0-31435
22.
Cayo Toaquiza M, Castro J, Ponce D, Castro A. Hemoglobina reticulocitaria y su
utilidad clínica en el diagnóstico temprano de eritropoyesis por deficiencia de
hierro absoluto en mujeres adolescentes. Revista vive. 2022; 5(14):3 37-347.
https://revistavive.org/index.php/revistavive/article/view/187Rethlefsen
23. Rethlefsen M, Kirtley S, Waffenschmidt S, Ayala A, Moher D, Page M.
PRISMA-S: an extension to the PRISMA Statement for Reporting Literature
Searches in Systematic Reviews. Syst Rev 2021; 10(1):39-56.
https://doi.org/10.1186/s13643-020-01542-z
24. Vázquez-López M, López-Ruzafa E, Ibáñez-Alcalde M, Martín-González M,
Bonillo-Perales A, Lendínez-Molinos F. The usefulness of reticulocyte
haemoglobin content, serum transferrin receptor and the sTfR-ferritin index to
identify iron deficiency in healthy children aged 1-16 years. Eur J Pediatr.
2019; 178(1): 41–49. https://doi.org/10.1007/s00431-018-3257-0
25. Dinh N, Cheanh S, Tran T. The validity of reticulocyte hemoglobin
content and percentage of hypochromic red blood cells for screening
iron-deficiency anemia among patients with end-stage renal disease: a
retrospective analysis. BMC Nephrol. 2020;
21(1):142-149. https://doi.org/10.1186/s12882-020-01796-8
26. Sedick Q, Elyamany G, Hawsawi H, Alotaibi S, Alabbas F, Almohammadi M.
Diagnostic accuracy of reticulocyte parameters on the sysmex XN 1000 for discriminating
iron deficiency anaemia and thalassaemia in Saudi Arabia. Am J Blood Res. 2021;
11(2): 172–179. https://pubmed.ncbi.nlm.nih.gov/34079632/
27. Aslam W, Habib M, Aziz S, Habib M. Reticulocyte Hemoglobin Equivalent:
Diagnostic Performance in Assessment of Iron Deficiency in Patients with
Hypothyroidism. Anemia 2021; 2021 (1):1–6. https://doi.org/10.1155/2021/9071057
28. Bahr T, Baer V, Ohls R, Christensen T, Ward D, Bennett S. Reconciling
markedly discordant values of serum ferritin versus reticulocyte hemoglobin
content. Journal of Perinatology. 2021; 41(3):619–626.
https://doi.org/10.1038/s41372-020-00845-2
29. Chinudomwong P, Binyasing A, Trongsakul R, Paisooksantivatana K.
Diagnostic performance of reticulocyte hemoglobin equivalent in assessing the
iron status. J Clin Lab Anal. 2020; 34(6) 1-7.
https://doi.org/10.1002/jcla.23225
30. Aedh A, Khalil S, Abd-Elkader A, El-Khawanky M, Alshehri H, Hussein A.
Reticulocyte Hemoglobin as a Screening Test for Iron Deficiency Anemia: A New
Cut-Off. Hematol Rep. 2023; 15(1):201-211.
https://doi.org/10.3390/hematolrep15010021
31. Almashjary M, Barefah A, Bahashwan S, Ashankyty I, ElFayoumi R,
Alzahrani Ml. Reticulocyte Hemoglobin-Equivalent Potentially Detects, Diagnoses
and Discriminates between Stages of Iron Deficiency with High Sensitivity and
Specificity. J Clin Med. 2022; 11(19):5675. https://doi.org/10.3390/jcm11195675
32. Uçar M, Falay M, Dağdas S, Ceran F, Urlu SM, Özet G. The
importance of RET-He in the diagnosis of iron deficiency and iron deficiency
anemia and the evaluation of response to oral iron therapy. J Med Biochem. 2019; 38(4):496–502.
https://doi.org/10.2478/jomb-2018-0052
33. Nalado A, Mahlangu J, Duarte R, Paget G, Olorunfemi G, Jacobson BF. Utility of reticulocyte haemoglobin content and percentage
hypochromic red cells as markers of iron deficiency anaemia among black CKD
patients in South Africa. PLoS One. 2018;
13(10): e0204899. https://doi.org/10.1371/journal.pone.0204899
34. Jamnok J, Sanchaisuriya K, Chaitriphop C, Sanchaisuriya P, Fucharoen G,
Fucharoen S. A New Indicator Derived From Reticulocyte Hemoglobin Content for
Screening Iron Deficiency in an Area Prevalent for Thalassemia. Lab Med. 2020;
51(5):498-506. https://doi.org/10.1093/labmed/lmz099
35. Pomrop M, Manopunya S, Tantiprabha W, Khuwuthyakorn V, Kosarat S,
Natesirinilkul R. Reticulocyte hemoglobin concentration for screening iron
deficiency in very low birth weight preterm neonates. The
Journal of Maternal-Fetal & Neonatal Medicine. 2022;
35(17):3348-3352. https://doi.org/10.1080/14767058.2020.181821
36. Tiwari A, Bhardwaj G, Arora D, Aggarwal G, Pabbi S, Dara RC, et al.
Applying newer parameter Ret‐He (reticulocyte haemoglobin equivalent) to assess
latent iron deficiency (LID) in blood donors-study at a tertiary care hospital
in india. Vox Sang. 2018; 113(7):63-646. https://doi.org/10.1111/vox.12700
37. Wang J, Qin L, Li C, Wu B, Dong T. A Hybrid Multiple
Attribute Decision-Making Model for Selecting Green Transportation Modes.
Biomedical and Environmental Sciences. 2020; 33(7):
543-546.https://doi.org/10.3967/bes2020.071
38. Neef V, Schmitt E, Bader P, Zierfuß F, Hintereder G, Steinbicker AU, et
al. The Reticulocyte Hemoglobin Equivalent as a Screening
Marker for Iron Deficiency and Iron Deficiency Anemia in Children. J
Clin Med. 2021;10(16): 3506.
https://doi.org/10.3390/jcm10163506
39. Balashova E, Mazur L, Persteneva P. Diagnostic value of reticulocyte
hemoglobin equivalent to confirm iron deficiency in full-term infants. Rossiyskiy Vestnik Perinatologii i Pediatrii. 2020;
65(3):44-52. https://doi.org/10.21508/1027-4065-2020-65-3-44-52
40. Sasangka B, Ratnaningsih T. Reticulocyte hemoglobin content (CHr) untuk
skrining defisiensi besi pada ibu hamil. Jurnal Gizi Klinik
Indonesia. 2019;16(1):40.
https://doi.org/10.22146/ijcn.27387
41. Sany D, El Shahawi Y, Taha J. Diagnosis of iron deficiency in
hemodialysis patients: Usefulness of measuring reticulocyte hemoglobin
equivalent. Saudi Journal of Kidney Diseases and
Transplantation. 2020; 31(6):1263. https://doi.org/10.4103/1319-2442.308335
42. Ammar S, Ghazy M, Mabrouk M, Gawaly A. Role of serum hepcidin and
reticulocyte hemoglobin concentration in evaluation of anemia in ulcerative
colitis patients. Journal of Applied Hematology. 2022;
13(1):28. https://doi.org/10.4103/joah.joah_127_21
43. Kumar Pattanayak A, Narayan Jali S, Tripathy D, Behera N, Kumar Behera
B. Role of reticulocyte hemoglobin content in diagnosis of iron deficiency
anemia. 2023; 16 (4): 61-68. https://doi.org/10.22159/ajpcr.2023.v16i4.47032
44. Bó S, Fragoso L, Farias M, Hubner P, de Castro S. Evaluation of RET-He
values as an early indicator of iron deficiency anemia in pregnant women. Hematol Transfus Cell Ther. 2023; 45(1):52–57.
https://pubmed.ncbi.nlm.nih.gov/34266811/
45. Thimthong N, Photi-a A, Traivaree C, Apipongrat D, Nathalang O.
Diagnosis of iron deficiency anemia in thai female adolescents using
reticulocyte hemoglobin equivalent. Journal of Southeast
Asian Medical Research. 2022; 6(1): 1-8.
https://www.jseamed.org/index.php/jseamed/article/view/126
46. Ning D, Yan-Hui M, Ping G. Reticulocyte hemoglobin content associated
with the risk iron deficiency anemia. Research Square. 2023, PREPRINT (Versión
1) https://doi.org/10.21203/rs.3.rs-2623503/v1
47. Chandrashekar K, T. YH, Reddy V. Utility of reticulocyte hemoglobin in
diagnosing latent iron deficiency and iron deficiency anemia. Int J Contemp
Pediatrics. 2020; 7(5):1049-1053.
https://doi.org/10.18203/2349-3291.ijcp20201636
48. Joosten E. Iron deficiency anemia in older adults: A review. Geriatr
Gerontol. 2018; 18(3): 373-379. 373–379.
https://pubmed.ncbi.nlm.nih.gov/29094497/
VIVE.
Revista de Investigación en Salud